简介:混悬制剂由分散在液体介质中的不溶性固体颗粒组成。混悬剂型包括口服混悬制剂、局部混悬制剂和气雾剂混悬制剂。无菌混悬剂型包括用于注射(皮下、肌内或关节内)的混悬制剂和用于眼部或耳部给药的混悬制剂。开发混悬剂型最常见的原因是由于API的水溶性较低。混悬制剂与溶液剂相比,它们的化学稳定性具有显著的提高。混悬液具有给药剂量准确,能够掩盖药物的不良气味,注射混悬剂可延长作用时间并避免首过代谢。虽然混悬液相比于口服固体制剂有诸多的优势,混悬剂仍然需要溶出或药物释放测试。如美国药典通用章节<1088>“剂型的体外和体内评估”中所述,所有非溶液口服制剂,包括舌下药物剂型,都需要进行溶出度测试。

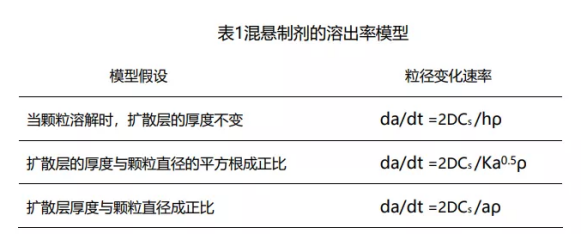
Abdou总结了基于准稳态扩散模型的混悬剂溶出机理,它们基于漏槽条件,具有球形颗粒形状的单分散颗粒和与浓度无关的扩散系数的假设。表1总结了这些模型,其中 h 是差异层厚度,并且显示了粒径(a)的变化率(da/dt)取决于药物溶解度(Cs),扩散系数(D )和颗粒密度(ρ),k 是一个常数。药物溶出率受到扩散层厚度及颗粒直径大小影响。
API的性质影响混悬制剂溶出速率,如API的溶解度、粒度分布及晶体类型。沉降和聚集有时会增加粒径,可能会降低溶出速率。另外,制剂的粘度同样的会影响混悬制剂溶出。
4 口服混悬制剂的溶出方法开发
联邦国际药学联合会(FIP)和美国药物科学家协会(AAPS)发表了一份意见书,讨论了新型和特殊剂型(包括混悬剂)溶出和体外释放试验的建议。推荐使用含水介质的桨法用于全身使用的口服混悬制剂。溶出介质和搅拌速度的选择应该能够区分具有不同批次药物的释放特性并且能够识别制造工艺的变化以及储存期间的产品变化。
4.1 仪器的选择和搅拌速度
口服混悬制剂在溶出过程中具有许多片剂和胶囊的生理化学特性。虽然桨法主要设计用于片剂,但它也是用于评估混悬剂溶出性能的主要技术。因为混悬制剂与已经崩解的片剂相似,所以混悬制剂的溶出测试使用较慢的桨速,一般在 25-75rpm 范围内。对于低粘度混悬剂,通常推荐 25rpm的搅拌速度,而高粘度混悬剂可能需要更高的速率,例如 50 或 75rpm。对于速释片剂而言,片剂的崩解可能是溶出速率的限制。由于混悬制剂中 API 的溶解没有开始所需的崩解步骤,因此在较高的搅拌速度下很难获得能够区分混悬制剂的溶出曲线。
4.2 介质选择
介质的选择对难溶性化合物的溶出有重要的影响。对于质量控制溶出测试,典型地使用具有在 1.2 至 7.4 的生理范围内的 pH 的水性介质。最终的介质 pH 值的选择应基于药物的 pH 溶解度曲线,漏槽条件优先考虑模拟体内情况和方法的耐用性。
对于难溶的化合物,可以使用合适的表面活性剂来帮助溶解。表面活性剂的使用是合理的,因为在胃肠道中存在天然表面活性剂。能够使用阴离子(例如十二烷基硫酸钠、脱氧胆酸钠),阳离子(例如十六烷基三甲氨基溴、十六烷基三甲基溴化铵)和中性的表面活性剂(例如吐温 20、吐温 80、Triton X-100、Brij-35)。方法中使用的表面活性剂的类型应考虑表面活性剂与制剂中药物和赋形剂的相容性。
5 混悬制剂的非药典溶出方法
如前所述桨法是混悬制剂中最常用的方法,也是USP专论和FDA溶出方法开发数据库中报道的唯一方法。文献描述了非药典溶出方法以表征混悬制剂的替代方法。在流通池法中使用透析管隔绝样品的透析适配器可应用于混悬液的体外释放测试。使用该方法可以区分地塞米松混悬制剂和脂质体制剂的释放,并且该方法还显示了在挤出和未挤出的脂质体之间地塞米松释放的区别。
6 小结
影响混悬制剂溶出包括 API 溶解度、粒度分布和多晶型,制剂的粘度、沉降、聚集等。理想的溶出方法应该足够敏感,以检测相关的产品变化,以确保产品的质量和一致的性能,以及预测药物的体内性能。